COVID-19:
RELEVANCIA DE
LAS PRUEBAS RÁPIDAS ANTIGÉNICAS PARA SU DIAGNÓSTICO
|
|
Elga Iglesias
Santiago, Veraguas karelg1819@yahoo.com https://orcid.org/0000-0001-7043-913X
|
|
|
|
|
|
Mitzy Montero
Hospital Regional Luis Chicho Fábrega, Santiago de Veraguas,
Panamá montero_mitzy@hotmail.com
https://orcid.org/0000-0002-3588-1501
|
|
|
|
|
|
Roxana Lau
Universidad Metropolitana de Educación, Ciencia
y Tecnología (UMECIT), Santiago, Veraguas
roxlau01@gmail.com https://orcid.org/0000-0001-6183-0209
|
DOI: 10.37594/saluta.v1i3.597
Fecha de recepción:18/01/2021 Fecha de revisión:23/02/2021 Fecha de aceptación:24/03/2021
RESUMEN
El
proyecto de investigación titulado: “COVID-19
Relevancia De Las Pruebas Rápidas Antigénicas Para Su Diagnóstico”,
tiene como objetivo conocer la importancia del
uso de las pruebas rápidas durante la pandemia de Covid-19. La
investigación es teórica descriptiva
de tipo documental, basado en documentos técnicos de la Organización Mundial de la Salud (OMS), sobre la detección de
antígeno para el SarCov-2 y artículos científicos publicados de fuentes internacionales en español e inglés desde
el 2019 al 2021, indexados en distintas bases de datos.
En la estrategia de búsquedas se emplearon distintos descriptores combinando
palabras y operadores boléanos utilizados fueron de intersección (AND), para establecer las operaciones lógicas entre
los conceptos y (OR) para recuperar documentos
donde aparezca uno, o al menos uno de los argumentos. Además, se utilizó
el gestor Zotero.
Se seleccionaron 8 artículos donde
se les realizó un análisis
del contenido. El estudio muestra
información sobre el tipo de prueba,
sensibilidad, especificidad, utilización, tipo de pacientes, valores predictivos; se evaluó
la sensibilidad y la especificidad, donde se determinó
que la prueba de Abbott BinaxNow y Panbio; con sensibilidades de 93.9%, 93.3% y 82.1 % respectivamente. Se obtuvieron valores
predictivos entre 50 -100 %, para diferentes tipos de muestras y
distintas metodologías. A pesar de lo que sostiene la literatura se obtuvieron sensibilidades aceptables, independiente
del lugar de toma de muestra ya fuera nasofaríngea como recomiendan diversos estudios o nasales, lo que ofrece
una ventaja en los pacientes pediátricos
y aquellos que presenten alguno tipo de padecimiento previo en las vías aéreas superiores.
Palabras Clave: Prueba rápida de antígeno,
SARS-Cov-2, COVID-19, Sensibilidad,
Especificidad.
COVID-19: RELEVANCE OF RAPID ANTIGEN TESTS FOR
ITS DIAGNOSIS
ABSTRACT
The present research entitled “Covid 19: Relevance of Rapid Antigenic Tests for Its Diagnosis”, aims
to know the importance of the use of rapid diagnostic tests during the Covid-19 pandemic.
A descriptive theoretical work of a documentary type is carried
out, based on technical
documents of the World Health Organization
on the detection
of antigen for SarCov-2 and scientific articles published from international sources in Spanish and English from
2019 to 2021, indexed in different
databases. In the search strategy, different descriptors were used combining words and Boléan operators used were intersection (AND),
to establish the logical operations
between the concepts and (OR) to retrieve documents where one, another or at least
one of the arguments appears. In addition, the Zotero
manager was used. Eight articles were selected and a content analysis was performed. The study highlights among its results information on the type of test, sensitivity, specificity, use, type of patients, predictive values; sensitivity and specificity were evaluated, where it was determined that the Abbott BinaxNow
and Panbio; with sensitivities of 93.9%, 93.3% and 82.1% respectively. Predictive values between 50-100%
were obtained for different types of samples and different methodologies. Despite what the
literature maintains, acceptable sensitivities were obtained, regardless of the place
where the sample was taken, whether it was nasopharyngeal as
recommended by various studies or nasal, which offers an advantage
in pediatric patients and those who present some type of previous disease in the upper airways.
Keywords:
Rapid antigen test, SARS-Cov-2, COVID-19, Sensitivity, Specificity.
INTRODUCCIÓN
La pandemia de COVID-19, es derivada de una
enfermedad ocasionada por el virus SARS-CoV-2,
el virus se transmite, a través de gotas de saliva, que se emiten al hablar, estornudar,
toser o respirar. Esto trajo consigo una exigencia diagnóstica para la
identificación de casos
de manera oportuna, debido a la rápida propagación en la comunidad de la infección causada por el nuevo coronavirus humano, el SARS-CoV-2 y las crecientes estadísticas de
mortalidad por la COVID-19, han generado una necesidad sin precedentes de
pruebas diagnósticas precisas para
una detección rápida y sensible. (García et al.,2020 s/f, pp. 190– 205)
Desde que se originó el brote de
casos de neumonía en la ciudad de Wuhan en diciembre
de 2019, cuya enfermedad posteriormente se conoció como SARS COVID-19, muchos cambios se han producido a nivel
mundial tanto político, social y económico. Con un índice de mortalidad entre
del 2 y 5% se hizo evidente
la necesidad de contar con métodos de diagnóstico confiables que permitieran detectar
lo casos positivos
y de esta manera lograr
evitar propagar la enfermedad y por consiguiente la mortalidad. (Aguilar
Ramírez et al., 2020, pp. 1–7).
Un riguroso cribado resulta
esencial para combatir
cualquier pandemia. La combinación de altos niveles de infección
asintomática, el hecho que las personas resulten contagiosas antes de desarrollar síntomas y la
logística y el gasto que implica el método más utilizado hasta la fecha
hicieron que el virus se propagara
sin ser detectado.
Desde el inicio de la pandemia
de COVID-19, los laboratorios están utilizando pruebas
de amplificación de ácidos nucleicos (PAAN), como la reacción en cadena
de la polimerasa con transcripción inversa en tiempo real (rRT-PCR), para detectar el SARS-CoV-2, que es el virus
causante de la enfermedad. Estas pruebas diagnósticas antigénicas están ideadas
para detectar directamente las
proteínas del SARS-CoV-2 producidas por los virus que se están replicando en las secreciones respiratorias, y se han desarrollado como pruebas de laboratorio y pruebas en el lugar de consulta o «de
cabecera», también llamadas pruebas diagnósticas rápidas (PDR). El panorama del desarrollo de pruebas diagnósticas es dinámico: hay casi un centenar de empresas que están diseñando o fabricando pruebas
rápidas de detección de antígenos del
SARS-CoV-2.(WHO-2019-nCoV-Antigen_Detection-2020.1-spa.pdf, s/f-a, pp. 1–11).
Estas pruebas rápidas pueden utilizarse:
•
Para crear espacios
libres de COVID-19: por ejemplo, para viajar en avión, en locales
de entretenimiento y eventos deportivos, o cualquier otro lugar donde se congregan
personas, incluyendo lugares
de trabajo. Los test resultarían suficientemente económicos como para utilizarse en escuelas y otros lugares
donde resulte necesario
efectuar pruebas frecuentes.
•
Para controlar nuevos brotes: efectuando test a poco más de la mitad de la población cada 3-7 días (media de 5 días) bastaría
para proteger a la otra mitad y reducir rápidamente
la tasa R0 por debajo de 1, lo que supone que cada persona infectada transmitiría al virus a menos de otra
persona
Estructura viral y características antigénicas del SARS-COV-2
Los Coronavirus, son grandes virus envueltos con genoma de ARN de sentido positivo
no segmentado que abarca aproximadamente 30 kilobases,
lo que los convierte en virus con el genoma
más grande conocido de todos virus de ARN. Al ser virus de ARN, los coronavirus evolucionan fácilmente por mutación
y recombinación homóloga
y no homóloga, los que les permite
expandir su rango de hospedadores y les facilita
el cruce de barreras de especies. Tienen
una variedad extensa
de reservorios animales,
especialmente entre murciélagos, y su plasticidad en términos de uso de receptores celulares
hace que los coronavirus sean altamente
eficaces en el cambio de hospedero, a través de amplias distancias taxonómicas. (García
et al., s/f, pp. 1–16)
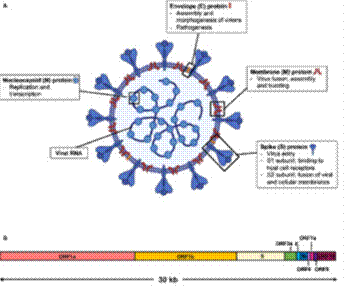
Figura
1. Diagrama esquemático de la
estructura y organización genómica del virus
SARS CoV-2. (A)
Las proteínas de la superficie viral, espiga (S), envoltura (E), y membrana
(M) están insertadas en una bicapa
lipídica. El ARN viral de cadena simple en sentido
positivo está asociada
con la proteína N de la nucleocápside. Diagrama
creado por BioRender. (B) Organización genómica
de SARS-CoV-2, la cual fue adaptada del GenBank, número
de acceso: MN908947, está caracterizada por el alineamiento
de secuencias contra dos miembros del género betacoronavirus. La secuencia completa del genoma tiene una longitud de 30 kilobases (kb). Tomado de: Lee CY- P, Lin RTP, Renia L and Ng
LFP. Serological Approaches for COVID-19: Epidemiologic Perspective on Surveillance and Control. Front.
Immunol. 2020; 11:879.
doi: 10.3389/fimmu.2020.00879
Un tipo de prueba de diagnóstico
rápido detecta la presencia de proteínas virales (antígenos) expresadas por el virus COVID-19 en una muestra del
tracto respiratorio de una persona.
Si el antígeno diana está presente en concentraciones suficientes en la
muestra, se unirá a anticuerpos específicos fijados a una tira de papel encerrada
en una carcasa de plástico
y generará una señal visualmente detectable, típicamente en 30 minutos.
Los antígenos detectados se expresan sólo cuando el virus se está replicando activamente; por lo tanto, estas pruebas se utilizan mejor para identificar una infección aguda o temprana.
Figura
2. Inmunocromatografía. Sobre una membrana de nitrocelulosa se
encuentran absorbidos en la línea de
reacción anticuerpos contra el antígeno que buscamos y sobre la línea de control anticuerpos anticonjugado
Fuente: elaboración propia
Cuando la muestra del paciente contiene
antígeno este queda
retenido en la línea de reacción. El conjugado, que también es un anticuerpo específico frente al antígeno que buscamos, está marcado con una
molécula de oro coloidal, que también fluye por la membrana, es retenido por el antígeno en la línea de reacción y
por el anticuerpo en la línea control. En el caso de muestras
negativas que no contienen antígeno,
el conjugado es retenido únicamente en la línea de control. (Chamorro & Onoda, 2020, pp. 1–9).
El funcionamiento de las pruebas
depende de varios factores, incluido
el tiempo desde el inicio de
la enfermedad, la concentración de virus en la muestra, la calidad de la muestra recolectada de una persona y cómo
se procesa, y sobre todo la formulación precisa de los reactivos en la muestra o kits de prueba. Según la
experiencia con pruebas rápidas, basadas en antígenos para otras enfermedades respiratorias como la influenza, en las que los pacientes afectados tienen concentraciones comparables del virus de la influenza en muestras respiratorias como se observa en
COVID-19, se podría esperar que la sensibilidad de estas pruebas varíe del 34% al 80%. (OMS, 2020, pp. 1–5)
Durante los primeros días tras el inicio de los síntomas
(de 1 a 5 días aproximadamente), se generan proteínas virales (antígenos)
que pueden ser detectadas mediante diferentes
ensayos (ELISA, inmunofluorescencia, o incluso pruebas
rápidas). Sin embargo,
no se ha caracterizado totalmente la dinámica de producción y
excreción de estas proteínas. En general,
la detección de antígenos presenta una especificidad aceptable (dependiendo del ensayo),
por lo cual su detección
puede ser usada como criterio
de confirmación (en conjunto con la definición de caso, la historia clínica
y los antecedentes epidemiológicos) y para tomar decisiones
en el ámbito de la salud pública (p. ej., aislamiento). Sin embargo, un
resultado negativo (en cualquier estadio
de la infección) no debe ser usado
como criterio para descartar un caso, y por lo tanto
se recomiendan pruebas
adicionales con ensayos
moleculares. (OPSIMSPHECOVID-19200038_spa.pdf, s/f,2020
pp. 1–11)
Existen tres tipos de pruebas para el SARS-CoV-2: las pruebas moleculares, las pruebas de detección de antígenos y las pruebas
de detección de anticuerpos.
Las pruebas de mayor demanda que
surgieron para el diagnóstico de SARS-CoV-2 fueron las pruebas rápidas
antigénicas (las cuales
generan resultados en tiempo no mayores a 30 minutos)
y las pruebas moleculares reacción
en cadena de la polimerasa con transcripción reversa
(RT-PCR ), esta última considerada el Gold estándar
para la detección
de la infección (Valencia
Portillo et al., 2020, pp. 1280–1283), sin embargo, era necesario considerar algunos
aspectos como la falta de disponibilidad de laboratorios moleculares con el personal
capacitado, el tiempo de entrega
de los resultados y los altos costos de esta tecnología.(Muñoz et al., 2021, pp. 135–143)
Por otra parte, las pruebas rápidas
antigénicas permiten ser utilizadas en lugares de difíciles accesos, ya que no requieren ningún tipo de
tecnología, el corto tiempo de entrega de
resultados y son mucho más económicas, sin embargo, hay que sopesar que son
menos sensibles y por consiguiente pueden mostrar un elevado porcentaje de resultados falsos negativos. (Aguilar Ramírez et al., 2020, pp. 1–7)
En cuanto a la sensibilidad, como se
ha mencionado ante¬riormente, es muy variable según estudios y marcas comercia¬les. En un estudio prepublicado
que analiza las pruebas rápidas en
España, PanbioTM COVID-19 Ag Rapid Test, en 412
pacientes sintomáticos, incluyendo
niños, atendidos en Atención Primaria encontraron una sensibilidad de 79.6% y una especificidad de 100% comparado con
RT-PCR como técnica de referencia. (Chamorro
& Onoda, 2020, pp. 1–9)
La
sensibilidad de las diferentes pruebas
de diagnóstico rápido
(PDR) en comparación con las técnicas moleculares pueden ser muy variables la
sensibilidad de los productos comerciales
varía entre el 40 % y 93 %, y la especificidad entre 93 % y 100 %. (Almonacid Urrego et al., 2020, pp. 43–52)
Aun así, la utilización de esta
prueba para el control de la Pandemia ha variado desde los primeros meses de la Pandemia a la actualidad, dependiendo
de la disponibilidad de la prueba y
de las recomendaciones internacionales, lo que estuvo marcado por las
diferencias socioeconómicas de los
países afectados. (C. Económica de A. L. y el C.
de, 2020)
El propósito de este trabajo es
realizar un análisis pormenorizado sobre la elección de las pruebas rápidas antigénicas para el manejo de la Pandemia,
recordando que su finalidad es el
diagnóstico rápido y oportuno ante la rápida propagación del virus.
CRONOLOGÍA DE ACONTECIMIENTOS: SARS-COV-2: UN VISTAZO
GLOBAL
En diciembre de 2019 China informa a la OMS de
una serie de casos de neumonía de etiología
desconocida.
Enero 2020 el mundo conoce que, en
Wuhan, China, hay un brote de una neumonía, porque
han procedido a cerrar un mercado de mariscos, suponen que ahí se dio el brote,
el mundo imagino que no cruzaría
fronteras esta gripe. El Comité Internacional de Taxonomía de Virus (CITV) designó al virus como
SARS-CoV-2. COVID-19 es el nombre de la enfermedad
provocada por el SARS-CoV-2. El
SARS-CoV-2 se ha clasificado dentro del género
Betacoronavirus (subgénero Sarbecovirus),
perteneciente a la familia Coronaviridae. (WHO-2019-nCoV-laboratory-2020.6-eng.pdf, s/f, pp. 1–26) a finales
de enero ya se conoce
de fallecimientos por la neumonía, con lo que además se dice que es una zoonosis, pues se
cree que la infección pudo llegar por alimentos exóticos
(murciélagos). En este mes se conocen también casos en Tailandia y
Japón, debido al turismo; China da a conocer la secuencia genética del
virus.
A partir de este punto, y previniendo que el virus se propagara a escala internacional, la OMS ofreció su
asesoramiento y guía para el manejo de esta nueva infección. No obstante, y a pesar de estos esfuerzos durante el
mes de enero, el número de infectados aumentó
rápidamente y se reportaron las primeras muertes10. Hacia final de mes,
el día 30 de enero la OMS declaró la
enfermedad causada por el nuevo coronavirus como una emergencia de salud pública de preocupación internacional, ya que para aquel momento
se habían reportado casos en todas las regiones de la OMS en sólo un
mes.(Mojica-Crespo & Morales-Crespo, 2020,
pp. 1–13).
El informe de situación de la OMS del
30 de enero señala la existencia de un total de 7818 casos confirmados en todo el mundo, la mayoría de ellos en
China y 82 en otros 18 países. La OMS
evalúa el riesgo en China como muy alto y el riesgo mundial como alto. (nCoVsitrep30Jan2020-eng.pdf, s/f, pp.
1–7).
En
febrero 2020, se denomina COVID-19
a la enfermedad, se conocen
casos en África
y Brasil.
El 13 de marzo 2020, se declara al
COVID 19 una Pandemia. De ese momento a la actualidad
las historias en cada país han sido de luto, sobresaturación del sistema salud, mutaciones y variantes del virus,
diferentes tipos de cuarentenas a nivel mundial, hoy día muchos hablamos de la tercera ola de infecciones.
Al 26 de enero de 2021, el panorama
de la OMS sobre las vacunas candidatas contra
la COVID-19 incluye 63 vacunas candidatas en fase de desarrollo clínico
y 173 en fase de desarrollo preclínico.(R&D Blue Print, 2021, pp.
1–3)
La OMS incluye en su portal reportes
diarios sobre los casos nuevos, actualización en porcentajes de fallecidos, el avance de la vacunación por regiones continentales, además hay países
que ahora solicitan a los viajeros
la tarjeta de vacunación, igualmente a nivel comercial muchos establecimientos lo solicitan para permitir el ingreso a sus locales,
a pesar de que la vacuna no es obligatoria, hay
tendencia a corroborar que las personas las hayan utilizado, con la finalidad
de evitar nuevos
contagios, estableciendo de alguna manera
“ambientes más
seguros o libres
de CoV-19”. Todo ello como un esfuerzo
por recuperar la economía mundial
que se ha visto golpeada ante la pandemia.
Luego de la vacunación masiva en las
Américas se ha logrado disminuir el número de
casos al igual que la tasa de muerte por esta enfermedad, lo cual se ve
reflejado en una baja de utilización
de las salas de cuidados intensivos que se habilitaron en todos los sistemas de salud a nivel mundial, aun así el uso de
los artículos de bioseguridad se mantiene en la gran mayoría de países, al igual que la indicación de lavado de
manos entre otras medidas.
PRUEBAS DIAGNÓSTICAS EXISTENTES
Al momento de que el médico solicita una prueba
diagnóstica para CoV-19 lo hace basado en la sintomatología del paciente, las declaraciones del entrevistado son importantes, puesto que de acuerdo al inicio de los
síntomas se toma la decisión de qué tipo de prueba solicitar al laboratorio. Igualmente, la cadena epidemiológica
al declarar que se ha tenido contacto
con positivos. A esto se le conoce como trazabilidad, lo cual es fundamental para poder hacer el estudio completo de los
posibles contagios a partir del listado de contactos que ofrece el paciente en la entrevista. Esto activa al sistema
de salud pública para que se haga un
estudio epidemiológico exhaustivo manteniendo la comunicación fluida de manera bidireccional con el paciente y sus contactos.
De igual manera se observa que puede
solicitarse un resultado negativo a personas
asintomáticas y sin cadena epidemiológica, por ejemplo:
•
Turismo (donde cada país/aerolínea exige un resultado negativo), hay clasificaciones de restricciones. Información de viaje respecto.
COVID-19,sf, (2020). https://www. espanol.skyscanner.com/restricciones-viaje
•
Citas medicas
El alto nivel de transmisión del
virus SARS-CoV-2 ha demostrado la importancia de disponer de pruebas
diagnósticas rápidas, sensibles y específicas que puedan identificar a las personas
infectadas, así como a aquellas que ya han sufrido la infección y han generado protección inmunológica. Actualmente las
pruebas diagnósticas que existen se basan en la detección de:
•
Material génico del
virus: PCR, Amplificación Isotérmica, CRISPR, PCR Digital, Secuenciación del Virus. (es la técnica
de diagnóstico más sensible y específica de la que se dispone en esta pandemia, ya
que detecta específicamente secuencias específicas
del ARN del SARS-CoV-2 desde la fase
asintomática de la incubación
hasta varias semanas
después de la resolución del cuadro clínico.
•
Antígenos virales
(Esta prueba de COVID-19 detecta ciertas proteínas en el virus. Algunas pruebas de antígenos pueden
producir resultados en minutos, y se hacen con un hisopo nasal largo que se
usa para obtener una muestra
de líquido.
•
Anticuerpos generados
frente al virus (La prueba de anticuerpos para COVID-19, que también se conoce como prueba de serología, es un análisis
de sangre que se
hace para saber si tuviste una infección con SARS-CoV-2. (Mojica-Crespo & Morales-Crespo, 2020, pp. 1–13)
Detección De Antígenos Virales De Coronavirus Sars-Cov-2 (Pruebas De Antígeno)
Basadas en la captura de antígenos específicos del virus mediante
sus anticuerpos específicos. Los antígenos del SARS-CoV-2 son los antígenos
N, S y el dominio RBD, siendo el antígeno
N el más abundante en el virus).
La técnica empleada
para el test de antígeno
suele ser la Inmunocromatográfia (lateral flow). Se trata de tiras reactivas donde se adsorben
los anticuerpos específicos frente a los antígenos. Se han comercializado diversos kits para la detección de antígenos del SARS-CoV-2, la mayoría de ellos como test rápidos (resultados
en 15-20 minutos).(WHO-2019-nCoV-Antigen_Detection-2020.1-spa.pdf, s/f-b, pp. 1–11).
Además, de la inmunocromatografía, existen
test diagnósticos para detección de antígenos
basados en otras tecnologías como inmunofluorescencia
(FIA), ellos requieren equipos específicos para su medición, los cuales tienen
exigencias de temperatura ambiental, mantener
sistema de electricidad, por lo que son utilizados en puestos fijos de
atención, esto estandariza la lectura de la reacción,
lo que disminuye el error humano a la vez que establece
un tiempo promedio para todas las muestras; pruebas de biosensores electroquímicos
y ópticos, El sistema de análisis
será portátil, autónomo, de fácil manejo, rápido (segundos desde la toma de la muestra al resultado) y ultrasensible para detectar inmunoglobulinas (Igs)
frente a la proteína S del SARS-CoV-2. (Gámiz
et al., 2020, pp. 1–13). Las pruebas rápidas
que son por lectura visual son útiles y prácticas para el trabajo de
campo que se realiza al visitar comunidades, así se lleva la trazabilidad de los casos
positivos.
La mayoría de los test se han
desarrollado para muestras nasales y orofaríngeas,
pero recientemente han aparecido otros que pueden emplear
saliva.
Estos test deberían usarse
para el diagnóstico rápido de la infección, particularmente en circunstancias de
transmisión comunitaria alta. Así se localizan y aíslan los casos positivos, lo cual es una medida
de contención a la diseminación del virus que conlleva a nuevos
contagios. Lo que hoy es una prueba que se
realiza como tamizajes a grupos de personas en
comunidades donde hay focos de infección, es muy probable que sea parte
del gabinete de ofertas de los
laboratorios clínicos de manera permanente, debido a las múltiples variantes que ha
presentado el virus y a los rebrotes que se
han dado en diferentes países.
SENSIBILIDAD, ESPECIFICIDAD, VALORES
PREDICTIVOS
En el sector salud, el laboratorio clínico
es responsable de realizar pruebas
que ayuden al médico tratante a complementar la
clínica del paciente y así llegar a un diagnóstico, una buena prueba diagnóstica debe dar positiva
en enfermos y negativa en sanos, de acuerdo a sus rangos de reportes y metodologías.
La
obtención del resultado
en minutos, contribuye a un diagnóstico oportuno y a un tratamiento eficiente, lo cual es
fundamental para que las personas no desarrollen o manifiesten complicaciones durante
el período de actividad del virus en el organismo, dichas manifestaciones
van a estar determinadas por la carga viral que tenga el individuo al igual que de la fortaleza de su sistema
inmunológico, como también de la edad, enfermedades crónicas que presente el individuo.
Por
estas razones todas
las pruebas o test deben tener validez
la cual implica
que tenga sensibilidad y especificidad, para la
determinación que realiza. Así evitamos resultados falsos negativos. Aumentando el valor predictivo de la prueba
o metodología utilizada, en la Pandemia de Covid-19 se suma el hecho,
que tengamos pruebas rápidas para el diagnóstico, que sea sencilla, que pueda aplicarse a una población general,
aunado al hecho de que no implique el uso de equipos sofisticados, así dar respuestas
oportunas, aislar los casos positivos
y de alguna
manera evitar un número mayor
de contagios. Por ello, es importante definir
los términos arriba citados y
así evaluar nuestra discusión.
•
Sensibilidad: prueba positiva en individuos enfermos
•
Especificidad: prueba negativa o normal en individuos sanos.
En ocasiones, pueden darse falsos
positivos o falsos negativos, por lo que se necesita conocer los valores predictivos de las pruebas (la capacidad que
tienen de no arrojas falsos positivos
o falsos negativos), lo cual nos ayuda en la elección de las pruebas a utilizar
para realizar el diagnóstico del
paciente.
Esto es sumamente
importante debido a que existen pacientes contagiados que cursan
asintomáticos durante la enfermedad, por lo que la sensibilidad
y especificidad de la prueba es un
tema de evaluación, a pesar de que no se recomiendan en este tipo de pacientes,
son útiles por ser rápidas,
muchas veces utilizadas por disposiciones o requisitos de citas médicas
o de viajeros, anteriormente explicado. Además de que cuentan como
pruebas diagnósticas en grupo de
personas de contacto de un positivo, epidemiológicamente utilizado para aislar casos,
donde la persona
no manifiesta síntomas,
pero al ser contacto estrecho
se incluye en el estudio, “En entornos cerrados (como residencias), los contactos asintomáticos
con exposición de bajo riesgo
se pueden analizar
mediante una prueba
rápida de antígenos.”
Figura No 3. Representación esquemática direccional de las
fórmulas para calcular la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor
predictivo negativo (VPN).
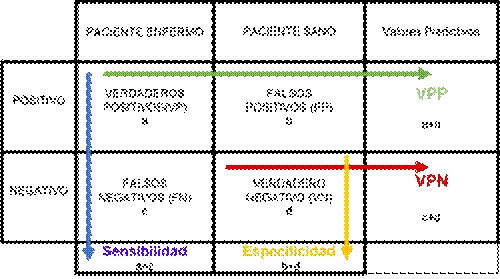
También se puede decir que:

Los conceptos de sensibilidad y especificidad permiten,
por lo tanto, valorar la validez de una prueba diagnóstica. Sin embargo,
carecen de utilidad en la práctica clínica. Tanto la sensibilidad como la especificidad proporcionan información acerca
de la probabilidad de obtener un resultado concreto
(positivo o negativo) en función de la verdadera condición del enfermo
con respecto a la enfermedad.(Pita Fernández, S., Pértegas Díaz, S., 2010, p. 1).
MATERIALES Y MÉTODOS
El tipo de investigación descriptiva fue de tipo documental y buscó determinar la importancia de la utilización de las
pruebas rápidas antigénicas para el diagnóstico de Covid-19 durante la pandemia; dado que le procedimiento implica
el rastreo, organización, sistematización
y análisis de un conjunto de documentos electrónicos sobre el tema en el periodo comprendido entre el 2019 y el
2021
Se hizo uso de material
bibliográfico y de bases de datos libres y suscritos,
incluidas Google académico, PubMed.gov, Science Direct, Lilac, y Science. Gov. Como
criterios de búsqueda se incluyeron los siguientes descriptores de la ciencia
de la salud (DeCS) “Pruebas
de antígeno”, “SARS-COV-2”, “Covid-19”, y Medical Subject Headings (MeSH) Antigen test” “antígeno”, “Covid-19 Antigen rapid testing” “COVID-19 Serological Testing” ; estos descriptores fueron combinados de diversas formas
al momento de realizar la búsqueda con el fin de
ampliar los criterios de búsqueda .En efecto se utilizó de los
operadores booleanos utilizados fueron de intersección (AND), para establecer
las operaciones lógicas entre los
conceptos y (OR) para recuperar documentos donde aparezca uno, otro
o al menos uno de los argumentos. Además, se utilizó
el gestor Zotero.
Algunas de fórmulas utilizadas en ingles tenemos con mayores
artículos encontrados:
•
(“COVID-19 Serological Testing”[Mesh]) AND “SARS-CoV-2”[Mesh])
•
(“COVID-19 antigen rapid testing”[Mesh]) AND “SARS-CoV-2”[Mesh])
Otras en español
•
“Pruebas de antígeno AND
SARS-COV-2”
Se establecen los criterios de
inclusión entre ellos 1) Artículos originales; 2) idioma inglés y español; 3) tiempo de marzo 2019 a mayo 2021; 4) tópico
de revisión: COVID-19 y pruebas rápidas de antígenos.
Primero, se realizó
la búsqueda de documentos, en distintas bases de datos; identificándose
6,170 artículos, luego en el primer filtrado se excluyeron 6090 artículos, porque no guardaba relación directa al
tema de revisión dándose una preseleccionaron 100 artículos. Para la organización de los documentos, se creó una
tabla de análisis y síntesis en Excel
con las siguientes categorías: Autor, Revista, Titulo, objetivo, Muestra,
sensibilidad, especificidad y
utilización en la pandemia; y poder realizar una comparación e identificar hallazgos comunes en los diferentes
estudios.
Una vez organizada la información, se agruparon los documentos mediante
dos núcleos temáticos: Sensibilidad, Especificidad y utilización en la Pandemia;
se seleccionaron 8 artículos y se excluyó
92 para posteriormente realizar un análisis de los núcleos
temáticos identificando los problemas, metodologías, instrumentos, resultados, definiendo lo más relevante y describiendo los aspectos comunes y
divergentes entre los documentos seleccionados.
Diagrama 1: Estrategias de búsqueda
Fuente: elaboración propia
Para la revisión y selección de los estudios,
después de identificar y eliminar los estudios
duplicados y comprobar los artículos que tenían pertinencia en el tema
abordado, fueron eliminados los que
no cumplían con este criterio, de los artículos restantes se realizó una clasificación aplicando
una matriz para extraer datos relevantes y proceder a la selección
según los núcleos temáticos a
analizar.
Para el análisis de resultados se
realizó una evaluación critica de 8 estudios incluidos, a través de un análisis temático del contenido, discusión de los
resultados obtenido; se establecieron
comparaciones, para presentar resultados de la presente revisión.
En esta revisión,
se encontraron 100 artículos en el primer filtrado; luego se aplicó el segundo filtrado como se mencionó anteriormente donde 92 no cumple con los criterios
de Inclusión y se seleccionaron 8 documentos para realizar el análisis.
Finalmente, se procedió a un análisis
de los resultados mostrados en la tabla 1 y las conclusiones.
En
los aspectos éticos,
aceptamos cumplir con los principios éticos y morales
que debe regir el estudio de revisión documental y
por tal motivo se solicitó exención al comité de ética por
considerarse un estudio sin participantes
humanos.
RESULTADOS
Para facilitar el análisis de los artículos
seleccionados, incluidos en la revisión,
se presenta una matriz
de discusión de resultados, reflejada
en el Tabla N°1
Tabla N°1. Matriz de Discusión de Resultados
|
País
|
Población
|
Prueba
|
Sensibilidad
|
Especificidad
|
Utilidad en la Pandemia
|
|
Bahrein
|
4183
|
Panbio
|
82.1%
|
99.1%
|
Sala
sintomática del Centro
nacional de pruebas en el centro de exposiciones
|
|
Bélgica
|
774
|
Respstrip
|
30%
|
100%
|
Hospital de 550 camas, con
un
laboratorio sin acceso a métodos moleculares
|
|
Chile
|
1453
|
Easy -11 Bioeasy Biotechnology Co.
|
93.9%
|
100%
|
Centro Médico privado en
Santiago
|
|
Francia
|
692
|
Panbio
|
|
|
|
|
|
|
Sintomático
|
66.7%
|
100%
|
Instalación de detección en la Universidad de Burdeos
|
|
|
|
Asintomáticos
|
36.4 %
|
|
|
|
País
|
Población
|
Prueba
|
Sensibilidad
|
Especificidad
|
Utilidad en la Pandemia
|
|
España
|
320
|
Panbio
|
60%
|
100%
|
|
|
|
|
CerTesT
|
53.5%
|
100%
|
Hospital Universitario Príncipe de Asturias y Centros de Atención Primaria asociados
|
|
Estados Unidos
|
878
|
Abbott BinaxNow
|
93.3%
|
99.9%
|
Plaza pública entre un punto
de intersección del sistema del metro para toda el área de la bahía
|
|
Noruega
|
4,857
|
Panbio
|
74.4%
|
99.9
|
Estación de prueba
Aker
|
|
Suiza
|
116
|
Estándar Q covid 19 SD biosensor
|
28,6%,
|
98,2%
|
Pacientes fueron evaluados al ser admitidos en un Hospital
comunitario de 250 camas en Morges, Suiza.
|
Fuente: Elaboración propia (2021)
Gráfica N°1. Comparación de Sensibilidad y Especificidad de las Pruebas
Evaluadas
Fuente: Elaboración propia (2021)
Grafica N°2. Comparación de la Sensibilidad vs el valor de ct
Fuente: Elaboración propia (2021)
Tabla N° 2. Valores predictivos según tipo de prueba y muestra.
|
Tipo de Muestra
|
Valores Predictivos
|
|
Inmunocromatográfia
|
|
Nasal
|
VPP=95.3% VPN=96.3%
|
|
Nasofaríngeas
|
VPP=100%
VPP=100% y VPN= 97.1 varia si son sinto- máticos
o asintomáticos
VPP=50% solo
sintomáticos
|
|
Frotis de garganta y nasofaríngeo
|
VPP=98.4% y VPN= 98.3
|
|
Inmunoensayo de
fluorescencia
|
|
Nasofaríngeo y orofaríngeo
|
Valor predictivo calculado de sensibilidad
VPP=100% y especificidad VPN=99.4
|
|
Inmunocromatográfia,
escaneado tarjeta posterior cuantificación bandas
|
|
Nasal
|
No presento tablas solo graficas
|
Fuente: Elaboración propia (2021)
DISCUSIÓN
La Organización Mundial de la Salud establece que
la sensibilidad mínima aceptada para
la PDR debe ser ≥80% y una
especificidad de ≤97 en comparación con el ensayo de PCR. (OMS. 2020. s/f, pp. 1–9)
Las pruebas de amplificación de ácido nucleico en
muestras del tracto respiratorio superior
(hisopos nasales o nasofaríngeos) presentan una sensibilidad muy variable y una especificidad muy alta.
Las pruebas de antígeno rápido
funcionan bien en pacientes con cargas virales altas, (valores de Ct ≤25 o >106 copias de
virus genómico / ml) que suelen aparecer en las fases presintomáticas (1-3 días antes del
inicio de los síntomas) y sintomáticas tempranas de la enfermedad (dentro de
los primeros 5-7 días de la
enfermedad). (OMS 2020, s/f, pp. 1–9)
En los 8 documentos seleccionados la sensibilidad
obtenida varió de acuerdo a la población que fue aplicada, ya sea sintomáticos o
asintomáticos, del intervalo de tiempo entre los primeros síntomas
y la toma de muestra
varió según protocolo
desarrollado por cada país.
El
virus se aísla
fácilmente si las muestras son tomadas durante
la primera semana
de síntomas, con mejor aislamiento en las muestras de esputo y disminuye
después del octavo día.(Wölfel et al., 2020, pp. 465–469). En la mayoría de los
estudios seleccionados se priorizó
la elección de la población
sintomática que contaba
con menos de 5 días de inicio
de síntomas.
Según la Tabla
N°1, las pruebas
que presentaron mayor
sensibilidad fueron: Easy
-11 Bioeasy Biotechnology Co., Abbott BinaxNow y Panbio; con sensibilidades de 93.9%, 93.3% y 82.1 % respectivamente.
La sensibilidad promedio
de las PDR, evaluadas en este estudio
es de 58.3 %.
Encontramos resultados interesantes como el de Panbio y Binaxnow cuya sensibilidad fue igualmente sensibles tanto en asintomáticos
como sintomáticos, inclusive se utilizó un sólo
hispo para las PDR y las RT-PCR, en contraparte la prueba Estándar Q covid 19 SD biosensor, mostro una sensibilidad al ser aplicada en pacientes asintomáticos
El Ct, del
inglés cycle threshold,
equivale al número de ciclos necesarios para que cada curva alcance un umbral en la señal de fluorescencia. La
comparación en los Ct entre las muestras permite
calcular la diferencia en la cantidad
inicial de las moléculas del ADN o ADNc específico que se desea evaluar,
ya que mientras mayor cantidad
del ADN blanco haya en una muestra, menor el número de ciclos (Ct) que se requiere para alcanzar este umbral.
(PCR-en-tiempo-real.pdf, s/f, pp. 175–201). Con respecto al Ct,
pudimos confirmar que existe una estrecha relación
entre el Ct y los valores
de sensibilidad, como podemos observar
en la Grafica N°1, para prueba de
Abbott BinaxNow, Easy -11 Bioeasy Biotechnology Co. y Panbio
De
momento hay pocos estudios que validan el uso del Ct, para guiar el manejo
de pacientes, los valores bajos pueden estar asociados con peores
diagnósticos, pero son necesarios evaluar
más estudios al respecto. Como en un estudio realizado
en Noruega donde pacientes
con valores menores de Ct de 30, tuvieron resultados
negativos en las pruebas rápidas. (Landaas et al., 2021, pp. 1–5).
En
este estudio obtuvimos
valores predictivos entre 50 -100 %,como podemos
observar en la tabla N°2, para
diferentes tipos de muestras y distintas metodologías, en su mayoría obtuvieron valores predictivos
dentro del estándar, ya que la población tamizada fue sintomática y asintomática; sin embargo en el estudio donde
se utilizó la prueba de Estándar Q
COVID 19 SD biosensor, el valor predictivo fue
inferior, porque sólo se tamizó la
población sintomática; la prevalencia afecta directamente la valoración de los
valores predictivos de la pruebas,
dentro de los estudios seleccionados, no se evidenció los cálculos para la determinación de estos valores.
Según Dinnes,
las prevalencia influirá en los falsos positivos y falsos negativos de las PDR,
donde podemos obtener
resultados tan dispares,
como con prevalencias de 0.5 y valores predictivos resultante entre 11% y 28%, dando resultados falsos positivos en proporción 7 de cada 10 y 9 de cada 10 respectivamente(Dinnes et al., 2021, pp. 1–412) ,Lo que impactaría negativamente en la confiablidad de los resultados aunado al perjuicio
a la población atendida.
A pesar, de lo que sostiene
la literatura se obtuvieron sensibilidades aceptables, independiente del lugar de toma de muestra ya fuera nasofaríngea como recomiendan diversos
estudios o nasales,
lo que ofrece una ventaja
en los pacientes pediátricos y aquellos que presenten
alguno tipo de padecimiento previo en las vías aéreas superiores.
Este estudio tiene la fortaleza que
incluyeron variables de distintos países, técnicas y grupos poblacionales variados, dándonos un percepción general de
los datos de sensibilidad y
especificidad para las PDR y los factores que pueden afectarla, como limitantes
podemos señalar que las mayoría
de los estudios carecían de valoraciones estadísticas que nos permitieran realizar cruces de variables, como la prevalencia de la enfermedad, puesto que esta varía según población y se podría estratificar mejor los resultados .
CONCLUSIONES
En base al análisis de los diferentes documentos
podemos inferir que el PDR es una herramienta
de mucha utilidad en el manejo de la pandemia, sin embargo, la efectividad y confiablidad del resultado va depender de
diferentes factores como: la prontitud de la toma de la muestra al inicio de los síntomas, la técnica utilizada y
los valores de carga viral que presente
el paciente.
El sistema de salud, deben tomar en
cuenta dichos factores a la hora de seleccionar y aplicar estas pruebas
en la población a tamizar,
lo que impactará en el control de la pandemia
en los distintos países en beneficio de la población, a nivel del ámbito
de Salud y aspectos económicos que afectan a la población por este
evento de salud publica
La
fortaleza de este enfoque, es el conocimiento basado en la experiencia y el conocimiento en las diferencias
analíticas que dan lugar a una interpretación clínica de los resultados.
Declaración de intereses en competencia
Los autores declaran
que no tienen intereses económicos
en competencia o relaciones
personales conocidas que puedan haber
influido en el trabajo informado en este documento.
REFERENCIAS BIBLIOGRÁFICAS
•
Aguilar Ramírez, P., Enriquez
Valencia, Y., Quiroz Carrillo, C.,
Valencia Ayala, E., de León Delgado, J., Pareja Cruz,
A., Aguilar Ramírez,
P., Enriquez Valencia, Y., Quiroz Carrillo, C., Valencia Ayala, E., de León Delgado, J., & Pareja Cruz, A. (2020). Pruebas diagnósticas para la COVID-19: La
importancia del antes y el después. Horizonte
Médico (Lima), 20(2). https://doi.org/10.24265/horizmed.2020.v20n2.14
•
Almonacid Urrego, C. C., Giratá Pedraza, M. V.,
Salcedo Pretelt, I., & Almonacid Urrego, I. C. (2020). Papel de las pruebas
rápidas (POCT) en el diagnóstico del SARS-COV-2, agente causal de COVID-19. Nova, 18(35), 43–52. https://doi. org/10.22490/24629448.4185
•
Chamorro, M. J. M., & Onoda, M. (2020). Pruebas
diagnósticas de SARS-CoV-2. 9.
•
Dinnes, J., Deeks, J. J., Berhane, S., Taylor, M., Adriano, A., Davenport, C., Dittrich, S., Emperador, D., Takwoingi, Y., Cunningham, J., Beese, S., Domen,
J., Dretzke, J., Ferrante di Ruffano, L., Harris, I. M., Price, M. J., Taylor-Phillips, S., Hooft, L.,
Leeflang, M. M., … Cochrane COVID-19 Diagnostic
Test Accuracy Group.
(2021). Rapid, point-of-care antigen and molecular-based tests for
diagnosis of SARS-CoV-2 infection. Cochrane
Database of Systematic Reviews. https://doi.org/10.1002/14651858. CD013705.pub2
•
Gámiz, F., Sampedro, C., Navarro, C., Salazar, N., Donetti, L., Márquez, C., Luis, J., Medina, C., & Galdón, J. C. (2020). Detection
of COVID-19 disease using graphene- based biosensors. 10.
•
García, C. D., Arias,
J. V., & Marval, L. E. (s/f). PRUEBAS ANTIGÉNICAS
EN LA VIGILANCIA EPIDEMIOLÓGICA DE COVID-19. 23, 16.
•
Landaas, E. T., Storm, M. L., Tollånes, M.
C., Barlinn, R., Kran,
A.-M. B., Bragstad,
K., Christensen, A., & Andreassen,
T. (2021). Diagnostic performance of a SARS- CoV-2 rapid antigen test in a large, Norwegian cohort. Journal of Clinical Virology, 137, 104789.
https://doi.org/10.1016/j.jcv.2021.104789
•
Mojica-Crespo, R.,
& Morales-Crespo, M. M. (2020). Pandemia COVID-19, la nueva emergencia sanitaria de preocupación internacional: Una revisión. Medicina
de Familia. SEMERGEN, 46, 65–77.
https://doi.org/10.1016/j.semerg.2020.05.010
•
Muñoz, W. A.,
Fuentes, D. B.,
& Urzúa, M. J. F. (2021). Rol de los laboratorios públicos en el diagnóstico SARS-CoV-2 en la pandemia
de COVID-19: Experiencia, desafíos y oportunidades. Revista Chilena de Infectología, 38(2), Article 2. https://www.revinf.cl/ index.php/revinf/article/view/1051
•
NCoVsitrep30Jan2020-eng.pdf.
(s/f). Recuperado el 7 de julio de 2021, de https:// apps.who.int/iris/bitstream/handle/10665/330775/nCoVsitrep30Jan2020-eng. pdf?sequence=1&isAllowed=y
•
OMS. (2020).
Consejos sobre el uso de pruebas de inmunodiagnóstico en el lugar de atención para COVID-19 [Informativa].
Consejos sobre el uso de pruebas de inmunodiagnóstico en el lugar
de atención para COVID-19. https://www.who.int/news- room/commentaries/detail/advice-on-the-use-of-point-of-care-immunodiagnostic- tests-for-covid-19
•
OPSIMSPHECOVID-19200038_spa.pdf. (s/f).
Recuperado el
9
de
noviembre de 2021, de https://iris.paho.org/bitstream/handle/10665.2/52471/ OPSIMSPHECOVID-19200038_spa.pdf?sequence=1&isAllowed=y
•
PCR-en-tiempo-real.pdf.
(s/f). Recuperado el 5 de julio de 2021, de https://www. researchgate.net/profile/Martha-Eugenia-Ruiz-Tachiquin/publication/259042551_ PCR_en_tiempo_real/links/53d119740cf2fd75bc5d725e/PCR-en-tiempo-real.pdf
•
Pita
Fernández, S., Pértegas Díaz, S. (2010, diciembre 7). Pruebas diagnósticas: Sensibilidad y especificidad. [Guías Clínicas]. Pruebas
diagnósticas: Sensibilidad y especificidad. https://www.fisterra.com/mbe/investiga/pruebas_diagnosticas/pruebas_diagnosticas.asp
•
R&D Blue Print. (2021). Rastreador de vacunas COVID-19 y paisaje. World Health Organization. https://www.who.int/publications/m/item/draft-landscape-of-covid-19- candidate-vaccines
•
Valencia Portillo, R.
T., Amorín Uscata, B.,
Gonzales-Zubiate, F. A., Juscamaita Medina, K., Sevillano, O. R., & Ramos-Sanchez, E. M. (2020). Pruebas rápidas para COVID-19,
la mejor alternativa para Ecuador. Bionatura, 5(3),
1280–1283. https://doi. org/10.21931/RB/2020.05.03.21
•
WHO-2019-nCoV-Antigen_Detection-2020.1-eng.pdf.
(s/f). Recuperado el 5 de julio de 2021, de https://apps.who.int/iris/bitstream/handle/10665/334253/WHO-2019- nCoV-Antigen_Detection-2020.1-eng.pdf?sequence=1&isAllowed=y
•
WHO-2019-nCoV-Antigen_Detection-2020.1-spa.pdf. (s/f-a).
Recuperado el 7 de julio de 2021, de https://apps.who.int/iris/bitstream/handle/10665/336028/WHO- 2019-nCoV-Antigen_Detection-2020.1-spa.pdf?sequence=1&isAllowed=y
•
WHO-2019-nCoV-Antigen_Detection-2020.1-spa.pdf. (s/f-b).
Recuperado el 7 de julio de 2021, de https://apps.who.int/iris/bitstream/handle/10665/336028/WHO- 2019-nCoV-Antigen_Detection-2020.1-spa.pdf?sequence=1&isAllowed=y
•
WHO-2019-nCoV-laboratory-2020.6-eng.pdf. (s/f). Recuperado el 7 de julio de 2021,
de https://apps.who.int/iris/bitstream/handle/10665/334254/WHO-2019-nCoV- laboratory-2020.6-eng.pdf?sequence=1&isAllowed=y
•
Wölfel, R., Corman, V. M., Guggemos, W., Seilmaier, M., Zange, S., Müller, M. A.,
Niemeyer, D., Jones, T. C., Vollmar, P., Rothe, C., Hoelscher, M., Bleicker, T., Brünink, S.,
Schneider, J., Ehmann, R., Zwirglmaier,
K., Drosten, C., & Wendtner,
C. (2020). Virological assessment of hospitalized patients with COVID-2019. Nature, 581(7809), 465–469. https://doi.org/10.1038/s41586-020-2196-x
SALUTA ISSN Impreso:
2519-0083 ISSN Electrónico: L2644-4003 Año 3. Número 3. Enero
- Junio 2021