USO DE MICROORGANISMOS EFICIENTES CON TECNOLOGÍA BIOFLOC
EN LA PRODUCCIÓN DE TILAPIAS
DOI:
10.37594/oratores.n15.507
Fecha de recepción: 22/07/2021 Fecha de revisión: 06/08/2021 Fecha de aceptación: 14/09/2021
RESUMEN
La presente
investigación tuvo como objetivo la búsqueda de una alternativa para el productor acuícola rural con poco acceso a los recursos
hídricos, para desarrollar la cría de tilapias. Se diseñó un estudio aplicando Biofloc
diariamente, que se constituyó de microorganismos eficientes (ME) a base de flóculos
bacterianos manipulados: Bacillus subtilis,
Bacillus spp, Bacillus megaterium, Bacillus amyloliquefaciens, Lactobacillus
y levaduras. Se aplicaron controles a nivel físico – químico del agua de una tina, con dos mil alevines de tilapias, cultivadas en el ciclo de estudio.
De acuerdo a los resultados obtenidos, podemos señalar que las variables
físicas se mantuvieron constantes
(pH, temperatura y transparencia, sin embargo, en algunos momentos se tenían
una turbiedad no deseada). En cuanto
a los parámetros químicos el oxígeno se mantuvo aceptable, el amonia, nitrito
y nitratos se determinaron no tan aceptables a nivel promedio por las
constantes variaciones, por lo tanto,
debe desarrollarse otros
análisis más profundos en cuanto a la estabilidad de los ME, como medio de limpieza y acondicionamiento del agua.
Además de considerar que si hay una
aportación por parte del Biofloc como medio de
mejoramiento nutricional de los peces, promoviendo
la formación de fitoplancton que son otros medios naturales del ecosistema para
la alimentación de estos organismos, sin afectar la disponibilidad de oxígeno.
Palabras clave: Microorganismos Eficientes; Bacterias; Oxígeno; Amonia; Nitrato; Nitrito,
Biofloc.
USE OF EFFICIENT MICROORGANISMS WITH
BIOFLOC TECHNOLOGY IN THE PRODUCTION OF TILAPIAS
ABSTRACT
The objective of this research was to search for an alternative for the rural
aquaculture
producer with little access to water resources, to develop tilapia farming. A simple study was designed
applying daily Biofloc, which consisted of efficient microorganisms (ME) based on manipulated bacterial flocs: Bacillus subtilis, Bacillus spp, Bacillus megaterium,
Bacillus amyloliquefaciens, Lactobacillus
and yeasts. Physical-chemical
controls of the water of a tub were applied, with
two thousand fry of tilapia, grown in the study
cycle. According to the results obtained,
we can point out that the physical variables
remained constant (pH, temperature and transparency, however, in some moments they
had an unwanted
turbidity). Regarding the chemical parameters,
the oxygen remained acceptable, the ammonia, nitrite and nitrates were determined
not so acceptable on average by the
constant variations, therefore, other deeper analyzes regarding the stability
of the MEs should be developed,
as a means of cleaning and conditioning the water. In addition to considering whether there is
a contribution by the Biofloc as a means of nutritional improvement of fish, promoting the formation of phytoplankton that are other natural
means of the ecosystem for feeding these organisms, without affecting the availability of oxygen.
Keywords: Efficient Microorganisms; Bacteria Oxygen; Ammonia; Nitrate; Nitrite, Biofloc.
INTRODUCCIÓN
La FAO (2019), en su
artículo Papel de la FAO en la
Acuicultura, señala a la misma como “el cultivo de organismos acuáticos tanto en zonas
costeras como del
interior que implica
intervenciones en el proceso
de cría para aumentar la producción, por lo tanto, podemos considerar que esta actividad
la cual no está promovida como comercial, ni de grandes
aportes económicos al país, se convertirá
en un movimiento de gran proyección al futuro como lo es en la actualidad para
otros países centroamericanos”.
Para ampliar el concepto citando a Aguirre,
Jorge I. (2005), señala: “La acuicultura
es una actividad interdisciplinaria
como quiera que en ella confluyen de manera integrada: biología, química,
física, estadística, ingeniería, economía y otras.
Es el cultivo de plantas
y animales útiles
en ambientes acuáticos confinados, hechos por el hombre, donde estos
organismos no pueden escapar y se realizan
la alimentación, reproducción, crecimiento y cosecha
de manera controlada. Ejemplo: peces, camarones, caracoles, ranas,
algas, arroz bajo inundación etc.”
Debemos tener presente que para
desarrollar la acuicultura es necesario dos elementos importantes que son el suministro de agua para recambio y
oxigenación del estanque, pileta o tina donde
se practica las actividades y mantenga los niveles físico químicos del
ecosistema, evitando posibles
elementos de contaminación y afectación del medio y el otro elemento es el
brindar una suplementación adecuada
que garantice la nutrición de los organismos cultivados, que se reflejan en el crecimiento y ganancia de peso
proporcional al tiempo de cultivo.
Esta panorámica nos motiva a buscar alternativas
para poder hacer más sostenible esta actividad,
permitiéndole al productor realizar hasta dos cebas de peces anual, demostrando
que es una actividad sostenible, sin embargo, es una preocupación el hecho que se demanda
gran cantidad de agua para recambio y oxigenación en
el proceso, es decir, se debe tener fuentes constantes de agua en todo el año.
Por estas razones se inicia esta
investigación, con el ánimo de proporcionar una opción técnica, que facilite
mejorar las condiciones del agua en cuanto a sus estándares físicos y químicos,
evitando se conviertan en sustancias toxicas para el entorno, afectando
el desarrollo de los peces, promoviendo
mejor uso de las fuentes de agua y evitar el gasto innecesario de este
importante recurso.
Podemos señalar que el objetivo de
este artículo es destacar el impacto que puede generar el uso de microorganismos eficientes,
mediante el sistema Biofloc en la producción de
tilapias y la sostenibilidad de la calidad físico química del agua.
Es importante señalar que esta
técnica es la primera experiencia a nivel del área acuícola, donde se aplicaron controles programados
para evaluar los Microorganismos eficientes como medio de limpieza y descomposición de material orgánico y el
seguimiento de parámetros físicos organolépticos del agua, como lo es el color,
olor, turbidez y su relación
con los cambios
químicos, como la
disponibilidad de oxígeno (O2), Amonia (NH3 / NH4+),
nitrato (NO3-) nitrito (NO2-) y el PH.
Entendiéndose que este proceso como
lo expresa Landino y Rodríguez (2011), son una combinación
de bacterias acido láctica, una bacteria fototrófica
y levadura, con capacidad sinérgica, sintrópica y metabiótica para disminuir la capacidad
contaminante de las aguas servidas.
BIOFLOC
Citando a Avnimelech, Y. (2015). Biolfocs Tehcnology, expresa que “son acumulaciones masivas de bacterias y otros microorganismos que conforman unas estructuras amorfas
de varios micrómetros hasta varios
milímetros llamados flóculos”.
Los flóculos limpian el
agua de substancias tóxicas tales como el amonio y nitrito del agua procedentes de la excreta
de nuestros organismos y materia orgánica
sobrante del alimento. De esta manera no es necesario realizar recambio
de agua alguno; sin embargo, la demanda de oxígeno es alta por tanto se debe implementar tener un sistema
de aireación que debe ser continua.
El Biofloc genera
importantes acciones probióticas para los peces,
debido a que entre las bacterias del Biofloc se encuentran algunas que actúan como probióticos, tal como bacterias del género Bacillus o Lactobacillus.
El
cultivo en Biofloc ejerce una acción de fortalecimiento del sistema inmune
de los organismos, los microorganismos presentes en el segregan lipopolisacáridos, peptidoglucanos
y ß-1,3-glucanos que parece mejorar
el sistema inmune
no específico de los organismos cultivados.
De Schryver
y colaboradores (2008), comprobaron que el cultivo con Biofloc
actuaba como control de agentes patógenos
(Vibrio campellii entre otros) debido
a la producción de ciertos
ácidos de cadena
corta (SCFA) tal como ácido
butírico, fórmico, acético,
propiónico
o ácidos valéricos.
Ekasari
et al. (2014); Xu y Pan (2013); “comprobaron que el Biofloc genera incremento
en Hemocitos totales, actividad fagocítica de hemocitos, actividad de superóxido dismutasa (defensa antioxidante), actividad prophenoloxidasa (pro PO), explosión oxidativa
en mecanismos de defensa
microbiana y supervivencia a enfermedades tales como la producida por virus myonecrosis (IMNV). Asimismo, se ha descrito que
algunas bacterias del género Bacillus sp., Alcaligenes sp., o Pseudomonas sp generan poly-ß-hydroxybutyrato (PHB) el
cual tiene un efecto contra ciertas cepas de Vibrio”.
MICROORGANISMOS
EFICIENTES (EM)
Son considerados un grupo de especies microbianas cuya presencia o inoculación en el suelo es capaz de mejorar
fertilidad física, química,
biológica y resistencia a patógenos entre otras. Ibáñez,
Juan, J. (2011).
Microorganismos Eficientes o Efectivos y Rehabilitación de suelos. Recuperado de https://www.madrimasd.org/blogs/universo/2011/03/02/137556.
EM, es una abreviación de Effective Microorganisms
(Microorganismos Eficaces, efectivos o
eficientes), cultivo mixto de microorganismos benéficos naturales, sin
manipulación genética, presentes en ecosistemas naturales, fisiológicamente compatibles unos con otros (Ecologic Maintenances, 2012).
Citando autores como Ramírez
(2009); y Fundases
(2014), exponen que cuando los EM son inoculado en el medio natural, el
efecto individual de cada microorganismo es ampliamente magnificado en una manera sinérgica por su acción en comunidad.
Conforme al orden natural, el mundo microbiano se puede clasificar, de una manera
genérica, en tres
grupos:
•
El
grupo de microorganismos regeneradores
•
El de los desintegradores
•
El de los neutrales.
Esta Tecnología nace en Ryukyu Daigaku en Okinawa, Japón creada por él Ingeniero Agrícola Doctor
Higa Teruo, profesor de Horticultura en la década de
los ochenta, relacionada con el uso de los microorganismos eficientes. Recuperado: https://www.tunuevainformacion.com/salud- integral/1069-el-dr-teruo-higa-y-el-milagro-de-los-microorganismos-eficientes-que-regeneran- nuestra-salud.html
En los inicios de los años sesenta,
el profesor Higa comienza la búsqueda de una alternativa que reemplazara los fertilizantes y pesticidas sintéticos,
popularizados después de la Segunda Guerra Mundial
para la producción de alimentos
en el mundo entero.
El Doctor Higa Teruo después de realizar muchos experimentos y pruebas durante
20 años, al no conseguir lo resultados que quería, tirando
el último experimento a un vertedero, a los pocos días pasando
cerca del vertedero
se fijó que en donde había tirado el experimento crecieron plantas y la putrefacción de esa zona había desaparecido. Logrando conseguir una convivencia simbiótica entre los microorganismos aeróbicos (los que necesitan oxigeno)
y los anaeróbicos (los que no necesitan oxigeno), para sobrevivir en dicha asociación los deshechos de
unos se comen los deshechos de otros
en una porción adecuada.
Nace así la base de una nueva forma
de ver la vida microbiológica, que tiene como objetivo brindar información sobre
los grupos de microorganismos benévolos tales antes mencionados como: Bacterias ácido láctico, bacterias
fototróficas,
grupo de los actinomicetos, grupo de las levaduras, y hongos presentes
en ecosistemas naturales, fisiológicamente compatibles unos con otros.
“El profesor
Higa al estudiar las funciones individuales de diferentes microorganismos, encuentra que el éxito de su efecto
potencializado estaba en su mezcla. Desde entonces, esta tecnología ha sido investigada, desarrollada y aplicada en una
multitud de usos agropecuarios y ambientales, y es utilizada en más de 80
países del mundo”. (Arias, 2010).
COMPONENTES DE BIOFLOC UTILIZADOS
Para el desarrollo de esta investigación, se utilizaron los ME. de la empresa
Agro Biológicos de Panamá (ABP) denominado Descomponedor de Materia
Orgánica (DMO), quienes detallan en su catálogo
Ficha Técnica Bacter DMO Para Uso Acuícola. (2018),
cuyos componentes son de los flóculos bacterianos manipulados: Bacillus
subtilis, Bacillus spp, Bacillus megaterium,
Bacillus amyloliquefaciens, Lactobacillus y levaduras a una concentración mínima de 1x10 9 ufc / cc, 100% orgánicos.
El
DMO se caracteriza por estar formulada con diversas cepas de microrganismos seleccionados como biocontroladores, bioremediadores y probióticos,
para lo cual adjuntamos el cuadro No. 1
que expone las principales acciones o funciones de estos.
Cuadro No. 1
Mecanismos de Acción de Bacterias con Potencial
Probióticos
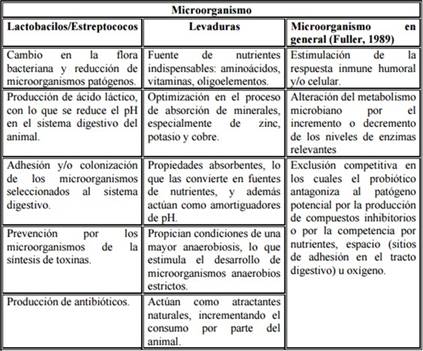
Fuente: ABP, (2018). Ficha Técnica Bacter DMO Para Uso
Acuícola.
Importancia
de los
Parametros
Físicos Químicos
en la Calidad del Agua en Acuicultura.
Cuando nos referimos a calidad del agua, citando a Aguirre,
Jorge. (2005), Guía Técnica de Acuicultura Rural, se define como “Cualquier
característica del agua que afecta la supervivencia, reproducción, crecimiento, producción o manejo de peces
en cualquier forma.”
“Es importante recordar
que el biofloc se basa en el uso de inóculos
que no es otra cosa que la sustancia
adicionada en el agua para acelerar la descomposición de los nitritos,
nitratos y amonio que son los
residuos orgánicos generados por los peces”, como señala
en conversación con Jaimes, Luis A. (2018), productor de tilapias de Caldas Colombia, se recomienda añadir
melaza pues, funciona como
carbohidrato soluble para alimentación del biofloc y
ayuda a controlar la toxicidad del
amonio.
Otro aspecto clave en la
implementación del Biofloc son los sistemas de
aireadores que ayudarán a una circulación constante del oxígeno
a través de la recirculación del agua por gravedad, una vez los sólidos orgánicos comiencen
el proceso, el tiempo establecido para que los aireadores permanezcan encendidos es de 24/7, de lo contrario la materia orgánica
va al fondo y se descompone afectando su cultivo y la producción.
Dentro de las
Variables de calidad
de agua, citando a Aguirre, Jorge I. (2005), Guía Técnica de Acuicultura Rural la define
como: “cualquier característica del agua que afecta la supervivencia, reproducción, crecimiento, producción o
manejo de peces en cualquier forma”; los cuales se presentan diversos parámetros permisibles en el cultivo de
tilapias.
Para nuestra investigación las variables evaluadas fueron:
a. Temperatura:
Citando a Aguirre, Jorge I. (2005), expresa que es un “parámetro importante que influye directamente en los organismos acuáticos afectando la respiración, el crecimiento y la reproducción, considerando que los peces son de sangre fría, por lo tanto,
su temperatura depende
del medio en que
viven (Poiquilotermo)”.
Los peces son organismos que no soportan
cambios bruscos de temperatura porque
esta afecta su fisiología, a mayor temperatura hay un aumento
en la intensidad de los procesos digestivos y la alimentación, ocurriendo lo contrario al
disminuir la temperatura.
Esta también
influye en la cantidad de oxígeno disuelto en el agua, ya que a mayor
temperatura el oxígeno disuelto es mayor y menor al caer la
temperatura.
b. Turbidez y Color:
El término turbidez indica que contiene “material
en suspensión en la columna de agua, el cual
interfiere con el paso de la luz solar y limitan el crecimiento de las algas”.
Aguirre Jorge I. (2005).
La turbidez en estanques o piletas acuícolas resultan de la presencia de organismos planctónicos que es una característica deseable, sin embargo, algunas veces
las partículas de arcillas u otras materias orgánicas en suspensión son altas cantidades y producen una
turbidez no deseada.
c.
Oxígeno Disuelto
(OD):
El OD es uno de los factores
o variables más críticas de la calidad
del agua en la acuicultura, cuyo grado de solubilidad de este
elemento depende de la altura
sobre el nivel
del mar, la temperatura y la
salinidad. Aguirre Jorge,
I. (2005).
La fuente primaria natural de producción
de oxígeno para los peces es mediante
la fotosíntesis de
las algas (fitoplancton), y la cantidad disponible va aumentando en la medida
que pasan las horas del día y también
disminuye en la medida que la altura aumenta.
Otro aspecto a considerar es que el
OD, disminuye por la respiración de peces, plancton, organismos bentónicos, descomposición de materia orgánica
(eutrofización) y por la difusión del oxígeno
del aire.
d. PH:
Este parámetro se refiere a la medición
del grado de acidez del agua, citando
el manual API. Freshwater Master Test Kit. (2018); un pH de 7.0 del agua
es neutro; un pH superior a 7.0 – 14.0 es
alcalino y un pH inferior a 0 - 7.0 es ácido.
En
una pileta o estanque el pH puede sugerir variaciones por la descomposición del alimento o del estiércol de los peces y por la
influencia de la concentración de dióxido de Carbono (CO2), por la tanto es importante establecer un
control semanal de esta variable a fin tener un adecuado mantenimiento de la tina y por lo tanto se tendrá un pH que promueva una buena calidad
del agua.
Aguirre, Jorge I. (2005), expresa que
para reducir el pH aplicando sulfato de amonio, por tener una reacción ácida del agua, ya que la alcalinidad puede
decrecer con el uso continuo de fertilizantes.
e.
Amoniaco:
El Amoniaco (NH3), proveniente del metabolismo de pez (orina,
defecaciones o las
branquias) y descomposición de la materia
orgánica, se transforma en Amonio (NH4),
siendo el amoniaco
no ionizado el más toxico para los peces. Aguirre, Jorge I.
(2005).
Es regulado el amoniaco por el pH y la
temperatura, donde un aumento del pH causa un
aumento de 10 veces en la proporción de amoniaco ionizado;
una fuerte concentración del amoniaco puede provocar la muerte de los peces, trazas de amoniaco estresan
los peces, incluso ralentizan el funcionamiento del sistema inmunitario
y su resistencia a enfermedades, cita del manual API. Freshwater Master Test Kit. (2018).
f.
Nitritos:
Se origina de la nitrificación a partir del amonio mediante
la acción de bacterias nitrificantes denominadas Nitrosomas ssp.
(clase de betaproteobacterias), por lo cual se forma
los nitritos, citando
el manual API. Freshwater Master Test Kit.
(2018); indica que: “El nitrito (NO2-)
presente en el agua es toxico y a una
fuerte concentración provoca la rápida muerte de los peces, incluso trazas de nitrito pueden estresar los peces,
ralentizando el funcionamiento de su sistema inmunitario y reducir
su resistencia a
enfermedades”.
g. Nitratos:
El Nitrato (NO3-),
se origina de la nitrificación del nitrito, mediante
la acción de las bacterias
nitrificantes denominadas Nitrobacter spp. (clase de alfaproteobacterias),
citando el manual API. Freshwater Master Test Kit. (2018); indica que: “Una fuerte concentración de nitrato indica
una acumulación de defecaciones de
los peces y de materias orgánicas, lo que afecta la calidad del agua y favorece la aparición de
enfermedades, además la alta concentración de nitrato favorece la cantidad
de nitrógeno y por lo tanto hay una
proliferación de alga”.
MATERIALES Y MÉTODOS
Esta investigación se desarrolló en la comunidad de Las Guías Abajo, corregimiento de las Guías,
distrito de Calobre, provincia de Veraguas, República
de Panamá, en las siguientes coordenadas
UTM (526334E – 906344N), en periodo del 16 de julio al 20 de diciembre de 2018, con un total de 5 meses de evaluación,
correspondientes a la época lluviosa.
Al momento de la siembra se sembró
una población de 2,000 alevines a la tina de concreto DE 62 M3. y en un estanque
de tierra zampeado
que se utilizó como testigo,
sembrado con un total de 1,000 alevines, de tilapias plateadas
(Oreochromis niloticus), el
estanque se proveerá de agua proveniente
de una toma de agua cercana dentro de la finca de un productor rural; es
importante resaltar que la tina de
concreto no tendrá renovación de agua, con la utilización de un sistema de aireación, que permitiera la oxigenación
de la tina y el uso de microorganismo eficientes, como también el control de los parámetros físicos químicos antes
resaltados.
El cultivo de alevines se manejó con un enfoque
de bajos recursos externos, considerando en
el futuro una base de datos para otras investigaciones que involucren costos y
productividad; por lo tanto, se suplemento las tilapias al 45, 40, 29 y 24 % de proteínas
a partir del segundo día de cultivo
hasta la culminación, como factor fundamental de la buena nutrición de estos organismos y se utilizaron las bacterias Bacter DMO como tecnología Biofloc
de investigación.
Se
aplicó una dosis de 27 Ml. de Biofloc al inicio de la investigación, lo cual varío de 50 Ml. y 10 grs. de azúcar hasta 804 Ml con 454 grs. de azúcar. A tanteo y error en la medida que los peces iban
creciendo y el nivel de turbiedad y demás desechos se incrementaban.
Se aplicaron los diversos procesos de control
mediante muestreos a nivel de agua para determinar parámetros físico químicos y muestreos biométricos, sin embargo, al presentarse varianzas en los resultados que indicaban
que los niveles químicos se elevaban se le aplicaba una dosis de DMO desde el primer día de cultivo.
Los controles aplicados se aplicaron
cada semana, en cuanto a temperatura, turbidez, pH, oxigeno, nitrito y nitratos, considerando dentro de los
parámetros establecidos para la acuicultura,
(ver Tabla No. 1)
Tabla No. 1
Parámetros y Rangos Físico Químicos permisibles en la Actividad Acuícola
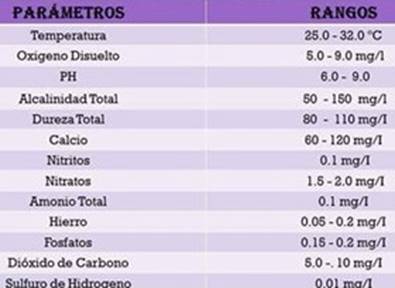
Fuente: García A. (2018), ARAP.
Calculo de parámetros Físico Químicos.
Para este control se utilizó el Master Test Kit, de la empresa API, FRESHWATER, donde se evaluaron los parámetros de
pH; Amonia, Nitrito
y Nitrato (Foto No.1).
Foto No. 1
Master Test Kid para control de Parámetros Químicos

Fuente: A. Gómez. (2018).
Inv. Uso de ME en cultivos de tilapia. UMECIT
Además, se evaluó los niveles de
oxígeno (O2) con el uso de un equipo HACH Modelo FF- 1A. Fish Farmer´s
Water Quality Test Kit
Manual. En cuanto al parámetro físico de turbiedad del agua, se utilizó un Disco Secchi de
20 cm. de diámetro con dos cuadrantes negros y dos blancos intercalados.
Los registros aplicados
y obtenidos se pueden observar
de cada control a continuación detallados:
♦ Temperatura:
En
cuanto a la temperatura, se tomó cada lectura mediante
el uso de un termómetro blindado para la
lectura de la temperatura, en horas de 8:00 a 10:00 a.m., colocando el
termómetro dentro del agua por un período de 5 minutos. Véase
foto No. 2.
Foto No. 2
Master Test Kid para control de Parámetros Químicos

Fuente: A. Gómez. (2018).
Inv. Uso de ME en cultivos de tilapia. UMECIT.
♦
PH:
Para determinar el potencial de hidrogeno del agua, se estableció el uso de reactivos del Test High Range pH; de la empresa API, FRESHWATER MASTER TEST KIT.
(Ver Foto No. 3), y las siguientes instrucciones de uso:
1. Llenar
un tubo de ensayo limpio de 5 ml., de agua del estanque.
2.
Añadir cinco (5) gotas de High
Range pH Test
Solution; manteniendo el frasco cuentagotas hacía abajo en posición vertical con el fin de que
las gotas sean uniformes.
3. Poner el tapón sobre el tubo de ensayo y mover varias veces el tubo con el fin de mezclar
la
solución.
4.
Leer el resultado del análisis comparando el color de la solución
con la carta High Range pH Color Chart.
El tubo debe colocarse en una zona bien iluminada sobre
el fondo blanco de la carta.
El color más parecido indica el pH de la muestra de agua; enjuagar el tubo de ensayo con agua limpia después de cada uso.
Foto No. 3
Control y Lectura de pH.

Fuente: A. Gómez. (2018).
Inv. Uso de ME en cultivos de tilapia. UMECIT
♦
Turbidez:
Se realizó introduciendo el Disco Secchi, hasta el punto que se restringe la visibilidad de los cuadrantes dentro del agua, es decir se
deje de apreciar los colores de los cuadrantes dentro del agua, midiéndose así en centímetro la
permeabilidad hacía en fondo del agua del estaque.
♦
Oxigeno Disponible:
Para el cálculo de este parámetro, se utilizó el Rango Alto de 1 a 20 Mg/L, se desarrollaron
los siguientes pasos:
1.
Sumerja la botella OD de vidrio con tapón en el agua del estanque o tina para hacer la prueba, permitir
que se llene hasta la parte superior.
2.
Asegúrese de que no
estén presentes burbujas de aire, inclinando la botella ligeramente inserte el tapón con un empuje rápido;
esto forzara el aire fuera de la muestra. Sí las burbujas quedan atrapadas en los pasos 2 y 3 la muestra debe ser
desechada, comenzar de nuevo la
prueba.
3.
Retire con cuidado el tapón de la botella,
añadir el contenido del reactivo de una almohada
en polvo de Oxígeno Disuelto 1 y un
Oxígeno Disuelto 2. Tapar el frasco firmemente para evitar el atrapamiento del aire.
4.
Sujete la botella y
agite vigorosamente; un retraso en la mezcla de la solución puede resultar
en que el polvo no se disuelva
adecuadamente. Un floculante formará el precipitado; si e oxigeno está presente,
el precipitado será marrón – naranja, la pequeña cantidad de reactivo
en polvo puede
permanecer en la parte inferior
de la botella, esto no le
hará afectar los resultados.
5.
Permita que la muestra
repose hasta que el floculo
quede establecido en medio y la mitad
de lo superior
de la botella este claro.
6. Agite la botella de nuevo.
7. Permita que el floculo
se establezca de nuevo.
8. Retire el tapón y agregue el contenido de una almohada
en polvo de Oxígeno Disuelto
3.
9.
Vuelva a colocar cuidadosamente el tapón y agite para mezclar. El floculo se disolverá y un color
amarillo se desarrollará en presencia de Oxigeno; esta es la
muestra preparada.
10. Rellene el tubo
plástico de medida a la parte
superior con la muestra preparada.
11. Verter el contenido del tubo en la botella
de mezcla.
12. Añadir la solución
de trisulfato de sodio, estándar
una gota a la vez en el contenido de la botella después de cada caída. Cuente
cada gota, continúe hasta que la muestra cambie de amarillo a incoloro.
13.
Cada
gota equivale a 1 mg/l. de oxígeno disuelto. Véase foto No 4.
Foto No. 4
Calculo y Lectura
de Oxígeno Disuelto
(OD).

Fuente: A. Gómez. (2018). Inv. uso de ME en cultivos
de tilapia. UMECIT
·
Amonio:
La prueba de amoniaco en base a salicilatos, lee el nivel total en ppm, que son equivalentes a miligramos por
litro (mg/L), de 0 ppm a 8.0 ppm (ml/L). Cuyas instrucciones de uso (Master
Test Kit) son las siguientes:
1.
Llenar el tubo de ensayo limpio con 5
ml de agua de la tina, (hasta la marca del tubo).
2.
Mantener vertical el frasco, añadir 8 gotas del frasco No. 1 de Amonia (NH3/NH4+) Test Solution.
3.
Luego manteniendo vertical el frasco, añadir 8 gotas del frasco No. 2 de Amonia (NH3/ NH4+)
Test Solution.
4. Poner el tapón sobre el tubo de ensayo
y agitar vigorosamente durante 5 segundos.
5. Esperar 5 minutos con el fin de que el color se desarrolle.
6.
Leer el resultado del
análisis comparando el color de la solución con la carta Ammonia Color chart. El tubo debe colocarse en una zona bien iluminada
sobre el fondo blanco de la
carta, ver foto No 5.
El color más parecido indica la concentración en
amoniaco mg/L, de la muestra de agua; enjuagar
el tubo de ensayo con agua limpia después de cada uso.
Foto No. 5
Análisis de Amonio

Fuente: A. Gómez. (2018). Inv. Uso de ME en cultivos
de tilapia. UMECIT.
·
Nitrito:
El análisis de la concentración de Nitrito debe efectuarse una vez por semana de la siguiente
manera (Master Test Kit):
1. Llenar
el tubo de ensayo limpio con 5 ml de agua de la tina, (hasta la marca del
tubo).
2. Manteniendo vertical
el frasco, añadir
5 gotas de Nitrito (NO2-)
Test Solution.
3. Poner el tapón sobre
el tubo de ensayo y agitar durante
5 segundos.
4. Esperar 5 minutos con el fin de que el color se desarrolle.
5.
Leer el resultado del análisis comparando el color de la solución
con la carta Nitrite Color Chart. El tubo debe colocarse en una zona
bien iluminada sobre el fondo blanco de la carta,
ver foto No 6.
El color más parecido indica
la concentración en nitrito mg/L,
de la muestra de agua;
enjuagar
el tubo con agua limpia después de cada uso.
Foto No. 6
Análisis de Nitrito

Fuente: A. Gómez. (2018).
Inv. Uso de ME en cultivos de tilapia. UMECIT
·
Nitrato:
La concentración de Nitrato (NO3-) del agua del
estanque debe ser analizada una vez por semana para asegurarse que está no alcance un umbral indeseable, con los siguientes pasos (Master Test Kit):
1.
Llenar un tubo de ensayo limpio
con 5 Ml de agua del estanque
(hasta la marca
de tubo).
2.
Añadir diez (10) gotas del frasco n° 1 del Nitrato
(NO3-) Test Solution, manteniendo e frasco cuentagotas hacía abajo en posición vertical con el
fin de que las gotas sean uniformes.
3.
Poner
el tapón sobre el tubo de ensayo y mover varias veces el tubo con el fin de mezclar
la solución.
4.
Agitar vigorosamente el frasco n° 2 de nitrato (NO3-) Test Solution durante
30 segundos, esta etapa es muy importante.
5.
Añadir luego 10 gotas del frasco n° 2 de nitrato
Test Solution, mantener
el frasco cuentagotas hacia abajo en posición vertical
con el fin de que las gotas
sean uniformes.
6.
Poner el tapón sobre el tubo de ensayo
y agitar vigorosamente durante un (1) minuto, esta
etapa es muy importante.
7. Esperar 5 minutos con el fin de que el color se desarrolle.
8.
Leer el resultado del análisis comparando el color de la solución
de la carta Nitrato Color
Chart, ver foto no. 6. El tubo debe colocarse en una zona bien iluminada
sobre el fondo blanco de la carta;
el color más parecido indica
la concentración en nitrato en mg/L de la muestra de agua, enjuagar el tubo de
ensayo con agua limpia después de cada uso.
Foto No. 7
Análisis de Nitrato.

Fuente: A. Gómez. (2018).
Inv. Uso de ME en cultivos de tilapia. UMECIT
RESULTADOS Y ANÁLISIS
En el análisis combinado de los parámetros Físico
- Químico del agua con el uso de Microorganismos Eficientes, los cuales eran agregados diariamente en horas de la mañana,
durante cinco meses de
controles, se observaron diferencias estadísticas que conllevan el resultado
del tratamiento de estas aguas
con Biofloc,
reflejados en los siguientes resultados:
♦
Temperatura se
tomaron veintidós muestras en la tina de estudio y estanque de testigo, donde se pudo constatar los siguientes datos (Ver gráfico
1).
Gráfica No. 1
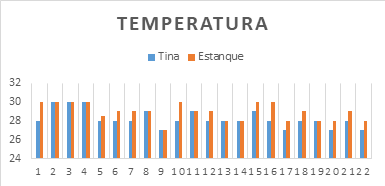
Fuente: Gómez, A. (2018). Inv. Uso
de ME en cultivos de tilapia. UMECIT
– ABP
Esto
evidencia pocos cambios
en la temperatura de ambos medios controlados, considerando que el promedio de la temperatura en todo el estudio se estimó en 28.23 °C de la tina y 28.93 °C en el estanque, con un mínimo de 27 °C y una
temperatura máxima de 30 °C en ambos. Deduciendo que no hubo cambios significativos con aplicación de ME y sin
ME, por esta razón consideramos que este
parámetro está dentro del rango permisible como adecuado para la explotación
acuícola, como indican algunos
autores previamente expuesto anteriormente.
·
Ph: Parámetro de gran importancia en la actividad
acuícola, por lo tanto, se establecieron los veintidós controles, donde se
constató los datos a continuación establecidos en la gráfica No. 2.
Gráfica No. 2
Controles del pH.
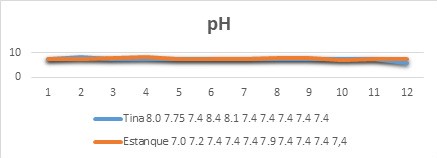
Fuente: Gómez, A. (2018). Inv. Uso
de ME en cultivos de tilapia. UMECIT
– ABP
Se observa una mayor homogeneidad en la tina con el uso del biofloc, que en el estanque
el cual presento
una pequeñas variaciones del Ph, esto puede ser debido
a la mayor presencia de estiércol y restos de alimentos en el
estanque, sin embargo en la tina se pudo obtener un pH máximo de 8.0 y hasta un pH mínimo de 5.8, en el estanque
también se presentó
un máximo de pH
y un mínimo de 7.0, hay que considerar que esto se presentar en la medida que
los peces van creciendo, hay mayor
consumo de alimento, donde la presencia de amonia y
demás componentes químicos formados
por procesos de la nitrificación del medio, alteran este factor, sin embargo,
se promedió en la tina y el estanque un pH de 7.5 para cada uno, considerándose un rango permisible en la ceba de tilapias.
·
Turbidez del Agua:
Los controles puntean que la tina promedio tuvo 22.73 cm de transparencia y el estanque
promedio 58.2 cm de transparencia, posiblemente la diferencia es el recambio de agua que se implementa en el estanque, esta
situación requiere mayor ampliación
de estudio en cuanto a la sostenibilidad de parte del biofloc
con respecto a los parámetros químicos, considerando que se presentó
un caso en plena investigación, a los 64 días de cultivo, mueren 250 peces, los parámetros del
agua eran 13 mg/ L de Oxígeno
disuelto, Amonio 0.5; Nitrito 1.0: Nitrato 5.0 y transparencia de 12 cm. Este nivel de turbiedad no se volvió a
registrar en el proceso, por tal razón sugerimos que se profundice en este aspecto, es evidente que el exceso de
turbiedad altera el ecosistema, con
un elevado nivel de oxígeno, provocando resultados negativos.
·
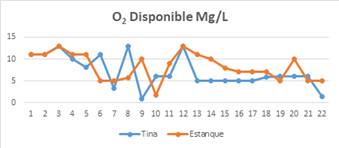
Oxigeno: este
componente químico de los más importantes para la supervivencia de los peces, resaltamos los controles tomados
en campo ver grafica No. 3. Que la presencia de oxígeno disuelto
fue bastante variable
principalmente en la tina, en cabio más homogénea en el estanque.
Gráfica No. 3
Fuente: Gómez,
A. (2018). Inv. Uso de ME en cultivos de tilapia.
UMECIT – ABP Observamos que tanto la tina y el estanque
el punto máximo de oxigeno disponible fue de 13 mg/L de agua, en cambio el mínimo de oxigeno que se registro
fue de 0.82 mg/L en la tina y de1.76 mg/L en el estanque,
promediándose de manera general 7.11 mg/L en la tina y 8.25 mg/L en el
estanque.
Situación que podemos deducirla por
diferentes razones, en el estanque hay recambio de agua constante y promueve una oxigenación mayor hasta en los
días nublados y donde hay poca presencia del sol, esto promueve la baja
del oxígeno en el agua,
en la tina, sin embargo,
aunque se trabajó con un oxigenador artificial (blower) y la adición
de ME. la disponibilidad del oxígeno fue menor.
Estas diferencias podrían suceder por crecimiento de los peces es continuo
y demandan mayor
cantidad de alimento, intensificando la cantidad
de material orgánico
residual. Estas situaciones no podemos
concluirlas como precisas hasta el momento y deben ser más profundizadas para
tener mejor elemento de juicios,
pero en general se puede decir que el promedio
de la oxigenación tanto de la tina como del estanque fueron
aceptables.
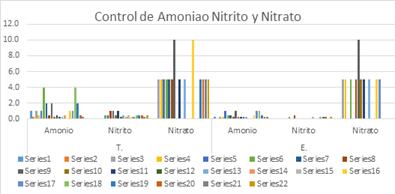
Amonio, Nitrito y Nitrato: Como lo
hemos señalado anteriormente este gas es originado, por la descomposición del amoniaco, generados por el exceso de
residuos de alimento y heces entre
otros elementos orgánicos que se presentan en el agua de un estanque o tina y
este mediante la nitrificación se
convierte en Nitrito y nitrato, por lo que se obtuvieron datos interesantes en
el grafico No. 4 que se detalla
a continuación.
Gráfica No. 4
Fuente: Gómez, A. (2018). Inv. Uso
de ME en cultivos de tilapia. UMECIT
– ABP
En
la tina se comprobó la presencia del amonio en su máximo
nivel de 4.0 ppm y un mínimo
de 0 ppm, en cambio en el estanque el máximo nivel fue de 1.0 ppm.
Calculándose un promedio de amonio para la tina de 1.0 ppm y 0.39 ppm en el estanque,
sin embargo, la teoría indica que el rango permisible es de 0.1 ppm o mg/L.
En
cuanto al nitrito,
este mantuvo mayor nivel en la tina con un máximo del nivel de 1.0 ppm y
en el estanque en donde se observó menor concentración de nitrito en 0.5 ppm,
en su más alto nivel. Se promedió los
niveles de nitritos para la tina en 0.39 ppm y para el estanque en 0.09 ppm, en este caso comparado con el nivel
permisible de 0.1 ppm o mg/L., por lo tanto,
es mejor el nivel del estanque que en la tina.
La presencia de Nitrato fue el de mayor
proporción durante la investigación, sin embargo, tanto en la tina como el testigo el mayor nivel de presencia fue
de 10 ppm, considerando como promedio para la tina 3.6 ppm y el estanque 2.5 ppm, de nitrato en todo el período, esto indica que el nivel de nitrato en la tina y en
el estanque no es tan permisible, como lo indica la teoría que establece un rango de 1.5 a 2.0 ppm o
mg/L.
Estos resultados como experiencia en el cultivo
de tilapias, se pueden considerar como una nueva base
de datos cuantitativos, que pueden servir de marco referencial para otras
futuras investigaciones y poder determinar ampliamente si los Microorganismos Eficientes pueden mantener
mejores indicadores de los parámetros aquí estudiados.
Es muy importante resaltar que
el estudio demuestra un significativo desarrollo de las tilapias, donde esta variable no fue parte
esencial de la investigación, sin embargo, los datos tomados
como simple referencia
estimaron una ganancia de peso con conversión de 1.20 gramos de peso ganado diario, esto indica que los peces
respondieron muy significativamente en este método productivo con Biofloc, lo
que sería recomendable realizar más estudios y poder resaltar el nivel de
mejora nutricional que incentiva los
microorganismos eficientes, donde se logró en un lapso de 5 meses obtener
peso al final de la cosecha de 350 gramos en promedio por tilapia.
CONCLUSIONES
•
La actividad acuícola
en el presente como en el pasado requiere para su ejecución la entrada constante de agua y suplemento
nutricionales para el crecimiento de los peces, sin embargo, bajo este sistema con la aplicación de
Biotecnologías podría desarrollarse en
zonas rurales con poco uso recurso hídrico.
•
No se observaron
enfermedades, sólo es importante tener un sistema de oxigenación y aplicación correcta de Biofloc diario.
•
Se debe aplicar
controles semanales de los factores
físico químicos, considerando el
mantener los niveles óptimos permisibles durante la ceba
de tilapias.
•
Bajo este sistema se
puede obtener desarrollos apropiados de los peces, por lo cual es necesario
adecuar otros estudios
que permitan mayor
información de las aportaciones de los Microorganismos Eficientes en la nutrición.
REFERENCIAS BIBLIOGRÁFICAS
•
Aguirre, Jorge, I. (2005).
Guía Técnica de Acuicultura Rural,
Manual para la instalación y manejo
de proyectos acuícolas. MIDA, Panamá.
Pp (1, 41-45).
•
Avnimelech, Y. (2015). Biolfocs Tehcnology- A Practical Guide Book, 3rd Edition. The World Aquaculture Society, Baton Rouge, Louisiana. United States.
•
Enunciado de exposición de japonés sobre los Microorganismos eficientes. (2010). Recuperado de: https://www.tunuevainformacion.com/salud-integral/1069-el-dr-teruo- higa-y-el-milagro-de-los-microorganismos-eficientes-que-regeneran-nuestra-salud.html
•
FAO.
(2019). Papel de la FAO en la acuicultura. Recuperado de: http://www.fao.org/
aquaculture/es/
•
Ibáñez, J. (2021).
Microorganismos Eficientes o Efectivos (EM) y Rehabilitación de Suelos | Un Universo invisible bajo nuestros pies. Retrieved 17 August 2021,
from https:// www.madrimasd.org/blogs/universo/2011/03/02/137556
•
Landino-Orjuela, G. y Rodríguez-Pulido, J.A. (2009). Efecto de Lactobacillus casei, Saccharomyces Rhodopseudomona palustris
(microorganismos eficientes em) y melaza en la ganancia de peso de tilapias (Oreochromis sp) en condiciones de
laboratorio. Recuperado de: https://www.researchgate.net/publication/38105532_Efecto_de_ Lactobacillus_casei_Saccharomyces_Rhodopseudomona_palustris_microorganismos_ eficientes_em_y_melaza_en_la_ganancia_de_peso_de_tilapias_Oreochromis_sp_en_ condiciones_de_laboratorio.
ORATORES ISSN Impreso: 2410-8928 ISSN Electrónico: L-2644-3988 Año 9. Número 15. Diciembre 2021- Mayo 2022